Bewertung (Punkte)
Reaktion
Augenöffnen
1
Kein Augenöffnen
2
Augenöffnen auf Schmerzreiz
3
Augenöffnen auf Ansprache
4
Spontanes Augenöffnen
Sprache
1
Keine verbale Reaktion
2
Unverständliche Laute
3
Schreien, nicht tröstbar
4
Schreien, tröstbar
5
Plappern, Brabbeln
Motorik
1
Keine motorische Reaktion
2
Strecksynergismen auf Schmerzreize
3
Beugesynergismen auf Schmerzreize
4
Ungezielte Schmerzabwehr
5
Gezielte Schmerzabwehr
6
Spontane Bewegungen
Der initiale GCS ist für die Versorgung eines Patienten von untergeordneter Bedeutung. Die Therapie richtet sich nach dem jeweiligen aktuellen klinisch-neurologischen Befund und dem Verlauf, der durch wiederholte engmaschige Untersuchungen erfasst werden muss.
17.1.1.4 Therapieziel
Das Ziel nach einem SHT ist es, das Ausmaß von sekundären Hirnschädigungen zu begrenzen und dem funktions-, aber noch nicht strukturgeschädigten Gehirngewebe optimale Bedingungen für eine funktionelle Regeneration zu schaffen. Die Therapie beginnt am Unfallort und setzt sich im Krankenhaus fort. Operationspflichtige Verletzungen müssen zeitig behandelt werden.
17.1.1.5 Indikationen zur Operation
Bei Patienten mit einem initialen GCS-Score von ≤8 sollte die Indikation zur Anlage einer Hirndruckmessonde zum Monitoring des intrakraniellen Drucks großzügig gestellt werden.
Raumfordernde intrakranielle Verletzungen wie sub- und epidurale Hämatome, Kontusionsblutungen, Impressionsfrakturen sowie eine massive Hirnschwellung stellen eine absolut dringliche Indikation zur Operation dar.
Offene oder geschlossene Impressionsfrakturen ohne Verlagerung der Mittellinienstrukturen, basale Frakturen und penetrierende Verletzungen mit Liquorrhoe stellen Operationen mit aufgeschobener Dringlichkeit dar.
Bei Ausschöpfen konservativer Therapiemaßnahmen zur Senkung eines erhöhten intrakraniellen Drucks ist die dekompressive Hemikraniektomie mit Duraerweiterungsplastik eine effiziente Methode.
In Einzelfällen ist bei nicht raumfordernden intrakraniellen Blutungen und stabilem neurologischen Befund ein nicht-operatives Vorgehen gerechtfertigt. Es muss aber eine engmaschige klinisch-neurologische sowie bildgebende Kontrolle erfolgen.
17.1.1.6 Neurochirurgische Eingriffe bei SHT
17.1.1.7 Traumatisches akutes Subduralhämatom
Die Letalität des akuten Subduralhämatoms beim schweren SHT ist hoch und wird mit 50–66 % angegeben (Sawauchi et al. 2004). Dies ist bedingt durch die begleitenden Verletzungen des Gehirns (kontusionelle Einblutungen) und die Ischämie, welche durch die rasche und starke Kompression hervorgerufen wird.
Ein raumforderndes akutes Subduralhämatom, unabhängig von der Hämatombreite, wird nach allgemeinem Konsens heutzutage umgehend operativ entlastet (◘ Abb. 17.1). Schmale, nicht raumfordernde Subduralhämatome können unter stetiger Observanz konservativ behandelt werden (Bullock et al. 2006). Gerinnungsstörungen müssen umgehend behoben werden.
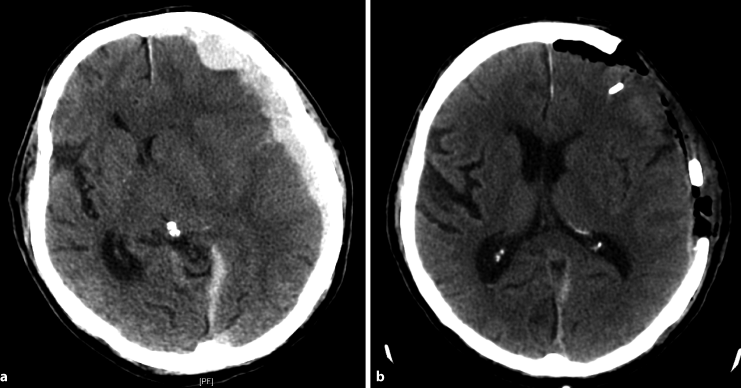

Abb. 17.1
a, b. Akutes Subduralhämatom. a Kranielle Computertomographie (CCT) mit Darstellung eines raumfordernden traumatisch-akuten Subduralhämatoms links. b Postoperative CCT-Kontrolle mit Entlastung des Subduralhämatoms über eine großzügige osteoklastische Kraniotomie, um dem evtl. nachfolgend anschwellenden Gehirn Raum zu geben. Links frontal wurde eine intraparenchymatöse Hirndruckmesssonde eingebracht
Bei komatösen Patienten mit beidseits weiten lichtstarren Pupillen ist die Prognose auch nach Entlastung im Allgemeinen schlecht (Petridis et al. 2009). Deshalb wird nur selten eine Entlastung vorgenommen. Eine Ausnahme stellt jedoch das SHT im Kindesalter oder in der Adoleszenz dar.
Akute subdurale Hämatome haben, wie oben erwähnt, eine hohe Letalität und können rasch zu Durchblutungsstörungen des Gehirns mit einklemmungsbedingten Infarkten insbesondere im Stromgebiet der A. cerebri posterior und A. cerebri anterior führen (◘ Abb. 17.2). Wie beim ischämischen Schlaganfall gilt auch hier: „Time is brain.“
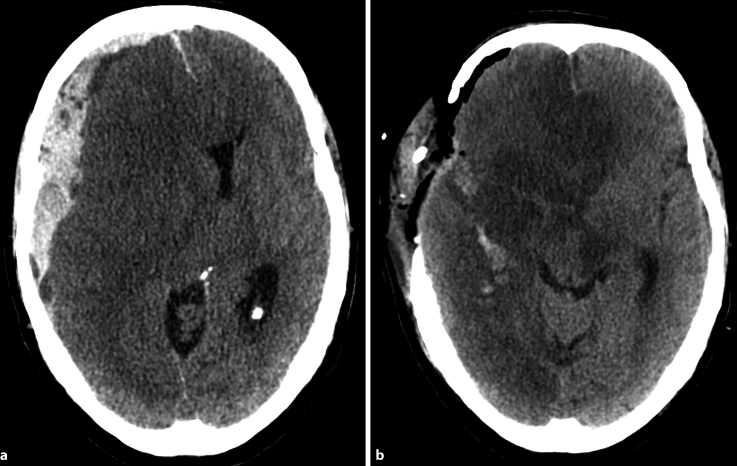

Abb. 17.2
a, b. Subduralhämatom mit einklemmungsbedingten Infarkten. a CCT: raumforderndes, akutes traumatisches Subduralhämatom rechts. b Postoperative CCT-Kontrolle nach Entlastung über eine große osteoklastische Kraniotomie rechts, mit Nachweis von typischen einklemmungsbedingten Infarkten im Posterior- und Anteriorstromgebiet rechts. Des Weiteren Nachweis der einklemmungsbedingten Schädigung des kontralateralen Hirnschenkels links
17.1.1.8 Traumatisches akutes Epiduralhämatom
Bei einem Epiduralhämatom handelt es sich um eine Einblutung zwischen Kalotte und Dura mater. Blutungsquellen können sein:
durale, arterielle Gefäße (häufig die A. meningea media),
Kalottenfrakturen und
durale, venöse Blutleiter (Sinusstrukturen).
Bei Kindern und jungen Erwachsenen kann es aufgrund der noch geringen Adhärenz der Dura mater an der Kalotte zu einer raschen und großflächigen Ausbildung eines Epiduralhämatoms kommen.
Bei einem raumfordernden akuten Epiduralhämatom besteht die Indikation zur sofortigen Operation (◘ Abb. 17.3). Schmale, nicht raumfordernde Epiduralhämatome, in der Regel venösen Ursprungs, können unter stetiger Observanz konservativ behandelt werden (Bullock et al. 2006). Gerinnungsstörungen müssen sofort behoben werden.
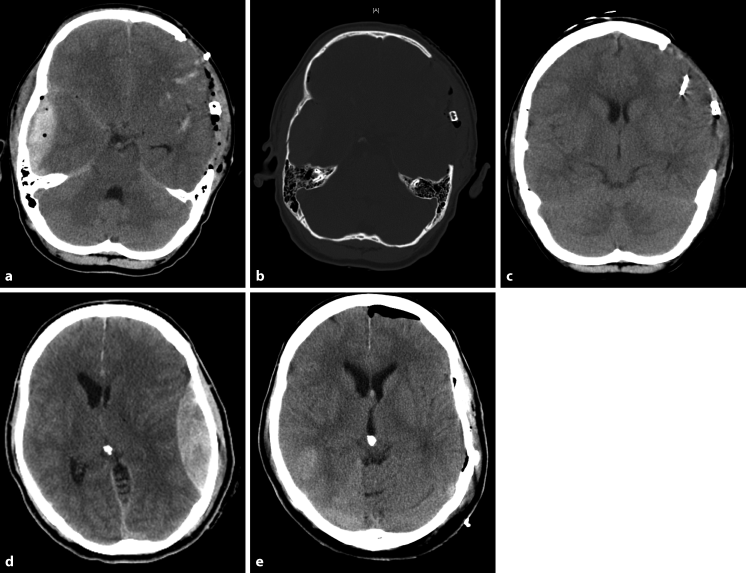

Abb. 17.3
a-e. Epiduralhämatom rechts. a, b CCT: raumforderndes akut-traumatisches Epiduralhämatom rechts temporal mit begleitender linearer Fraktur der Kalotte. Blutungsquelle: A. meningea media. Linksseitig wurde bereits ein akutes Subduralhämatom über eine osteoklastische Kraniotomie entlastet. c Postoperative CCT-Kontrolle nach Entlastung des akuten Epiduralhämatoms rechts temporal über eine osteoplastische Kraniotomie. Links frontal befindet sich eine intraparenchymatöse Hirndrucksonde. Epiduralhämatom links. CCT: raumforderndes akut-traumatisches Epiduralhämatom links temporal. d Vor der OP, e nach der OP. Blutungsquelle: A. meningea media
17.1.1.9 Impressionsfrakturen
Impressionsfrakturen sollten bei Verlagerung um Kalottenbreite operiert werden (Bullock et al. 2006) (◘ Abb. 17.4). Durch Impression des Kortex können im weiteren Verlauf epileptische Anfälle generiert werden.
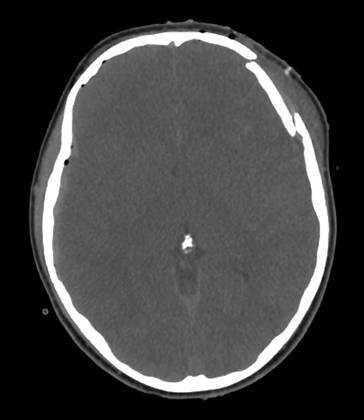

Abb. 17.4.
CCT: Impressionsfraktur links frontal, die um Kalottenbreite verschoben ist und zu einer lokalen kortikalen Impression führt. Es besteht die Indikation zur Operation
17.1.1.10 Dekompressive Hemikraniektomie bei SHT
Bei ausgeprägter Hirnschwellung mit konsekutivem Mittelhirnsyndrom (ein- oder beidseitig) oder bei konservativ nicht beherrschten pathologischen Hirndruckanstiegen ist eine dekompressive Hemikraniektomie indiziert (Aarabi et al. 2006). Hierbei ist es wichtig, die Kraniektomie weit nach basal-temporal zu ziehen, um eine ausreichende Entlastung zu gewährleisten (◘ Abb. 17.5). In einer jüngeren Arbeit wurde der Wert der bilateralen Kraniektomie infrage gestellt (Cooper et al. 2011). Diese Studie blieb jedoch nicht ohne Kritik.
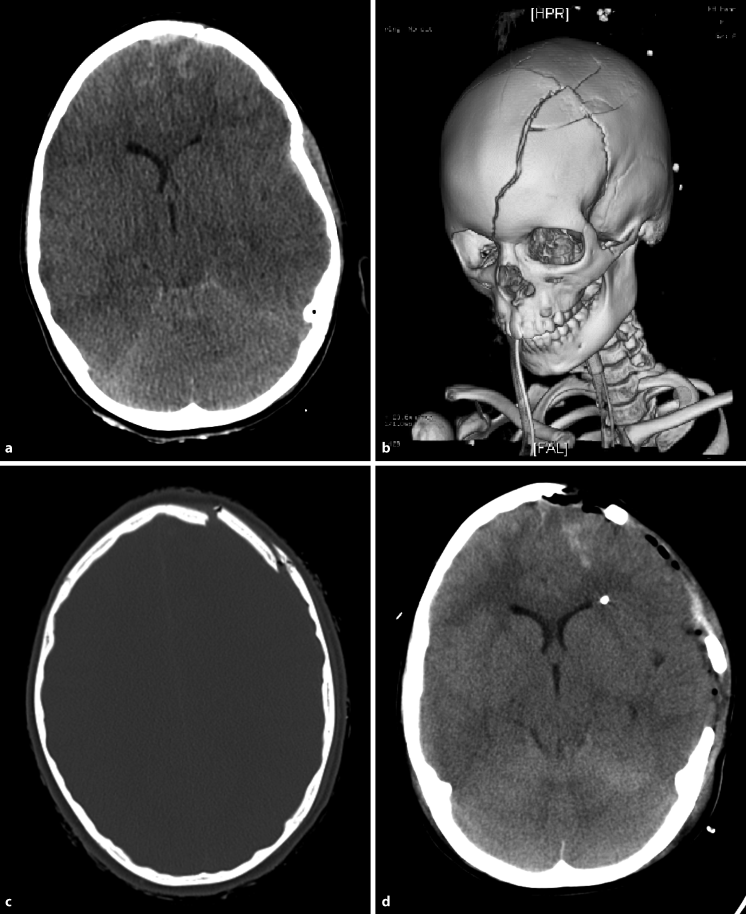

Abb. 17.5
a-d. SHT bei ausgeprägter Hirnschwellung. a-c CCT: 10-jähriges Mädchen mit einem schwerem SHT (GCS 3) durch Verkehrsunfall mit generalisierter, linksbetonter Hirnschwellung, Kontusionierungen links frontal sowie einer Kalottenfraktur mit partieller Im- und Expression. Klinisch links weite, lichtstarre Pupille. d Postoperative CCT-Kontrolle nach dekompressiver Hemikraniektomie links. Intraparenchymatöse Hirndrucksonde links frontal. Klinisch beide Pupillen eng und lichtreagibel. Hirndruckwerte um 10 mmHg
17.1.1.11 Komplexe Gesichts- und Hirnschädelfrakturen
Komplexe Gesichts- und Hirnschädelverletzungen (◘ Abb. 17.6) mit Beteiligung der Fronto- oder Temporobasis können durch Verletzung der Dura zu einer Liquorrhoe führen (offenes SHT). Darüber hinaus können die Sehnerven durch Frakturteile komprimiert werden. Im Bereich des Felsenbeins können der N. facialis und der N. vestibulocochlearis beschädigt werden. Die Versorgung dieser komplexen Verletzungen erfordert ein interdisziplinäres Vorgehen unter Beteiligung der jeweiligen Fachdisziplinen (HNO, Augenheilkunde, Mund-, Kiefer- und Gesichtschirurgie, Neurochirurgie).
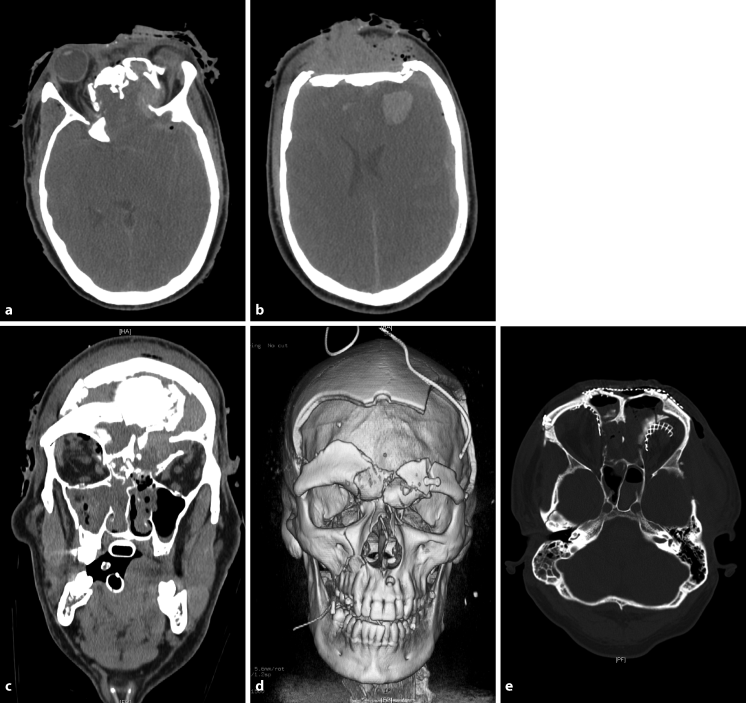

Abb. 17.6
a-e. Komplexe Gesichts- und Hirnschädelverletzungen. a-d CCT mit dreidimensionaler Rekonstruktion: Patient mit ausgedehnten, komplizierten Frakturen des frontobasalen Hirn- und Gesichtsschädels unter Einbeziehung beider Orbitae. e Postoperative CCT-Kontrolle nach interdisziplinärer Versorgung mit Rekonstruktion des Hirn- und Gesichtsschädels und Deckung der Frontobasis bei Rhinoliquorrhoe
17.1.2 Intrazerebrale Blutung
Etwa 15 % aller Schlaganfälle sind durch intrazerebrale oder ventrikuläre Blutungen verursacht. Als Ursachen kommen infrage:
arterielle Hypertonie (65 %),
zerebrale Amyloidangiopathie (15 %),
Gerinnungsanomalien, Antikoagulanzien (zusammen etwa 12 %),
vaskuläre Malformationen und
Tumoren.
Die Inzidenz beträgt etwa 10–30/100.000 Einwohner in Europa, in Japan etwa 60/100.000.
Bei etwa der Hälfte der Patienten kommt es in den ersten 24 Stunden nach dem Blutungsereignis zu einer Nachblutung, die zu einer akuten Verschlechterung des Zustands führen kann (Quereshi et al. 2009; Aguilar et al. 2010). Die Computertomographie ist die primäre apparative Untersuchungstechnik. Bei V.a. auf eine ursächliche Gefäßmalformation sollte eine Angiographie der Hirngefäße erfolgen. Bei V.a. auf einen Tumor oder ein Kavernom ist eine Magnetresonanztomographie erforderlich.
Die Wertigkeit neurochirurgischer Maßnahmen ist noch nicht eindeutig geklärt. Es hat sich aber gezeigt, dass manche Patienten von einer Hämatomentlastung profitieren können.
17.1.2.1 Operationsindikationen bei supratentoriellen Blutungen
Die Indikation zur Operation ist gegeben, wenn ein neurologisches Defizit oder eine Bewusstseinstrübung vorwiegend auf eine hämatombedingte Kompression zurückgeführt wird (◘ Abb. 17.7 a, b). Andererseits ist die Operationsindikation vorsichtig zu stellen, wenn das neurologische Defizit vorwiegend auf die primäre Destruktion durch die Blutung zurückzuführen ist (◘ Abb. 17.7 c, d).
Im Allgemeinen wird die Operationsindikation bei oberflächlichen Großhirnblutungen (Lobärblutungen) gestellt, wenn sie ein Volumen >50–100 ml haben (◘ Abb. 17.7 e-h); bei Kleinhirnblutungen ist die Operationsindikation bei Hämatomen >20–30 ml gegeben (◘ Abb. 17.7 i, j). Bei Blutungen der Basalganglien und des Hirnstamms besteht selten eine Operationsindikation. Bei Auftreten einer Liquorzirkulationsstörung durch Einbruch der Blutung in das Ventrikelsystem mit konsekutiver klinischer Verschlechterung ist die Anlage einer externen Ventrikeldrainage indiziert.
Bei einer desolaten Prognose aufgrund des neurologischen oder Allgemeinzustands sollte von einer Operation abgesehen werden. Patienten >65 Jahre und mit einem GCS <10 haben im Allgemeinen eine schlechte Prognose. Bei kleinen Blutungen (supratentoriell) besteht keine Operationsindikation.
17.1.2.2 Zusammenfassung
Die Wertigkeit neurochirurgischer Eingriffe bei der spontanen intrazerebralen Blutung ist noch nicht hinreichend geklärt. Es gibt Hinweise, dass durch neurochirurgische Maßnahmen im Vergleich zu einer konservativen Therapie das Risiko, an einer Blutung zu sterben oder mit einem schweren neurologischen Defizit zu überleben, geringer ist. Möglicherweise profitieren insbesondere Patienten mit oberflächlichen Blutungen von neurochirurgischen Eingriffen. Alter und Bewusstseinsszustand des Patienten sowie Größe und Lokalisation fließen in die Entscheidung zur Operation mit ein.
17.1.2.3 Operationsindikation bei Kleinhirnblutung
Häufigste Ursache einer Kleinhirnblutung ist die arterielle Hypertonie. Darüber hinaus können aber auch Tumoren und Gefäßmalformationen dafür verantwortlich sein. Etwa 5–10 % der intrazerebralen Blutungen sind zerebellär. Der Altersgipfel liegt zwischen der 6.–8. Lebensdekade.
Indikationen zur operativen Intervention bei einer Kleinhirnblutung sind:
Blutungsdurchmesser >3 cm, mit Zeichen der Raumforderung bzw. Volumen >20–30 ml,
beginnende Bewusstseinsstörung,
Hirnstammzeichen,
Liquorzirkulationsstörungen (Hydrocephalus occlusus).
Wegen der Möglichkeit einer raschen klinischen Verschlechterung und der postoperativen guten funktionellen Ergebnisse sollte die Indikation großzügig gestellt werden (◘ Abb. 17.7 i, j). Bei einem manifesten Hydrocephalus occlusus ist die Anlage einer externen Ventrikeldrainage erforderlich (◘ Abb. 17.8) (Quereshi et al. 2009; Damman et al. 2011; Heros 1982; Da Pian et al. 1984; Dunne et al. 1987).
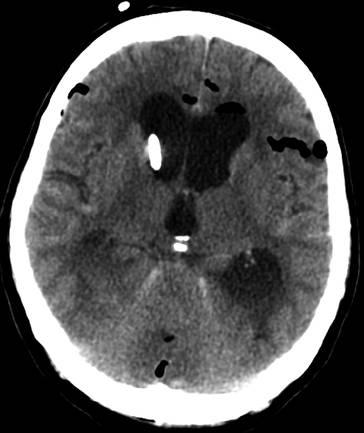

Abb. 17.8.
CCT: einliegende externe Ventrikeldrainage bei konsekutivem Hydrocephalus occlusus
Bei Verdacht auf eine tumorbedingte Blutung oder eine Blutung, verursacht durch eine Gefäßmalmalformation, ist die weitere Abklärung mittels Kernspintomographie bzw. Angiographie der Hirngefäße erforderlich.
17.1.3 Aneurysmatische subarachnoidale Blutung
17.1.3.1 Epidemiologie
Die Inzidenz der nicht-traumatischen Subarachnoidalblutung (SAB) beträgt etwa 10/100.000 Einwohner/Jahr in Mitteleuropa und USA. In Finnland und Japan findet sich eine Inzidenz von etwa 20/100.000 Einwohner/Jahr. Davon sind ca. 85 % durch die Ruptur eines intrakraniellen, arteriellen Aneurysmas bedingt. Der Häufigkeitsgipfel liegt bei 50 Lebensjahren. Frauen sind etwas häufiger betroffen als Männer. Zu den Risikofaktoren zählen
Zigarettenrauchen,
arterieller Bluthochdruck,
starker Alkoholkonsum und
erstgradige Verwandte mit SAB (van Gijn et al. 2001, 2007; Bederson et al. 2009).
17.1.3.2 Diagnostik
17.1.3.3 Klinisch
Leitsymptom ist der plötzliche diffuse Kopfschmerz noch nie erlebter Intensität (Donnerschlagkopfschmerz). Noch charakteristischer als seine Intensität ist die Akuität mit Erreichen des Schmerzmaximums binnen weniger Sekunden. Etwa 10–15 % der Patienten versterben vor der Einlieferung in eine Klinik. Von den hospitalisierten Patienten zeigen zwei Drittel bei Aufnahme eine verminderte Bewusstseinslage. Andere häufige Initialsymptome sind
Übelkeit,
Erbrechen,
Nackensteife und
Krampfanfall.
Die prognostisch bedeutsame Klassifikation des klinischen Schweregrads erfolgt nach den Skalen von Hunt und Hess (◘ Tab. 17.2) oder der World Federation of Neurological Surgeons (◘ Tab. 17.3). Die 30-Tages-Letalität inkl. Prähospitalphase beträgt etwa 45–50 % (Bederson et al. 2009).
Tab. 17.2.
Einteilung des klinisch-neurologischen Zustands nach Subarachnoidalblutung (Graduierung nach Hunt und Hess)
Grad | Symptombeschreibung |
|---|---|
1 | Asymptomatisch oder leichte Kopfschmerzen, leichter Meningismus |
2 | Hirnnervenausfälle, mäßige bis schwere Kopfschmerzen, Meningismus |
3 | Leichte fokal-neurologische Defizite, Vigilanzminderung, Desorientierung |
4 | Sopor, mäßige bis schwere Hemiparese |
5 | Koma, Dezerebration, moribund |
(Hunt et al. 1968) | |
Tab. 17.3.
Einteilung des klinisch-neurologischen Zustands nach Subarachnoidalblutung (Graduierung nach der WFNS, World Federation of Neurological Surgeons)
Grad | GCS-Punkte | Fokales neurologisches Defizit (Aphasie, Hemiparese) |
|---|---|---|
1 | 15 | Nein |
2 | 13–14 | Nein |
3 | 13–14 | Ja |
4 | 7–12 | Ja oder nein |
5 | 3–6 | Ja oder nein |
(Teasdale et al. 1988) | ||
17.1.3.4 Apparativ
Priorität hat die kraniale Computertomographie (CCT) (◘ Abb. 17.9 a). Sie besitzt am ersten Krankheitstag eine Sensitivität von 95 %, die danach allerdings abfällt.
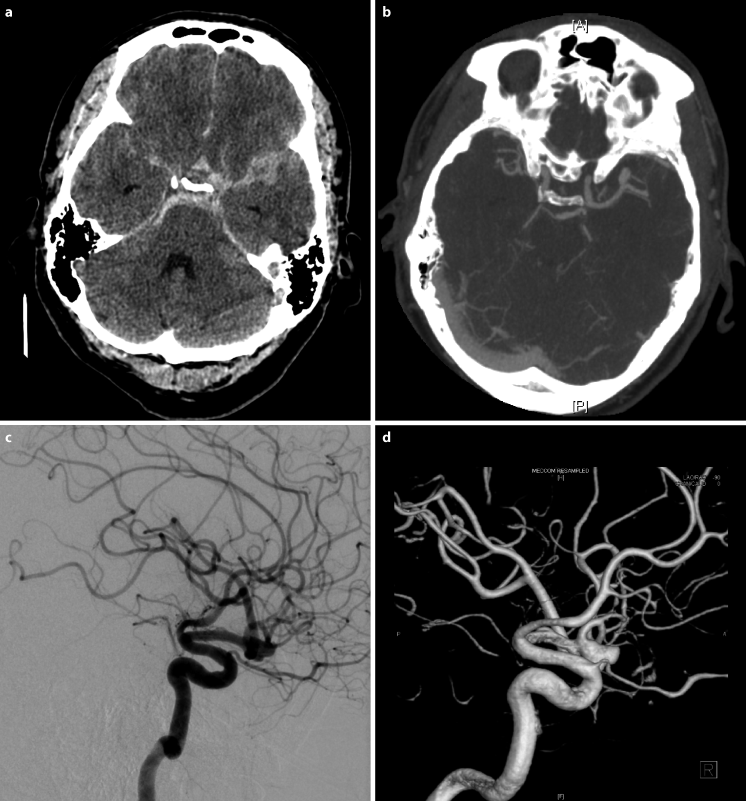
Abb. 17.9
a-d. Apparative Untersuchungen. a CCT: subarachnoidale Blutung in den basalen Zisternen sowie der Sylvischen Fissur. b CT-Angiographie: Darstellung eines sackförmigen Aneurysmas der A. cerebri media links in der Bifurkation. c Digitale Subtraktionsangiographie (DSA ) der Hirngefäße (A. carotis interna links, seitlich gedrehte Darstellung): nach ventral gerichtetes, sackförmiges Aneurysma der Mediabifurkation links. d DSA der A. carotis interna links in dreidimensionaler, seitlich gedrehter Darstellung: nach vorne gerichtetes, sackförmiges Aneurysma der Mediabifurkation
Die Magnetresonanztomographie (MRT) in Protonendichte- oder FLAIR-Wichtung erreicht in den ersten Tagen ähnliche Werte, ist aber oft schlechter verfügbar.
Bei unauffälligem CCT (oder MRT) ist eine Lumbalpunktion zum Auschluss einer SAB erforderlich.
Bei Nachweis einer SAB muss nach der Blutungsquelle gesucht werden. Goldstandard ist die transfemorale Panangiographie der hirnversorgenden Gefäße (◘ Abb. 17.9 c, d) inkl. gedrehter Aufnahmen und ggf. Aufnahmen unter Kompression.
In den letzten Jahren hat sich als Notfalluntersuchung die CT-Angiographie (◘ Abb. 17.9 b) zunehmend etabliert. Multiple Aneurysmen finden sich in ca. 25 % der Fälle (Bederson et al. 2009).
17.1.3.5 Pathomechanismen
Die Aneurysmaruptur führt zu einer intrakraniellen Drucksteigerung. Diese kann arterielle Druckwerte erreichen. Hierdurch kann es bis hin zum intrakraniellen Kreislaufstillstand mit primär letalem Ausgang (ca. 10 %) kommen. Dieser je nach Blutungsausmaß variabel verlaufende hämorrhagisch-hypoxisch-ischämische Iktus bestimmt bereits wesentlich die neurologische Erholungsmöglichkeit.
Bedingt durch einen subarachnoidalen Resorptionsblock entwickeln ca. 25 % aller Patienten in der Akutphase einen symptomatischen Hydrozephalus.
Zwischen Tag 4 und 17 nach der Blutung kann es zu Vasospasmen der zerebralen Arterien mit konsekutiven Ischämien und Infarkten und entsprechenden neurologischen Ausfallerscheinungen (verzögert auftretende ischämische neurologische Defizite) kommen. Die Infarkte führen wiederum zu einer Hirnschwellung. Oft zeitlich koinzident mit dem Vasospasmus entwickeln sich Natriurese, Hyponatriämie, Hypovolämie und Fieber. Diese Komplikationen sind pathophysiologisch nur zum Teil verstanden und begünstigen die sekundären Ischämien.
Extrazerebrale Organfunktionsstörungen nach SAB betreffen vor allem das kardiopulmonale System (myokardiale Nekrosen, verminderte Herzauswurfleistung, neurogenes Lungenödem) (Bederson et al. 2009; van Gijn et al. 2007, 2001).
17.1.3.6 Ausschaltung des Aneurysmas aus dem Blutkreislauf
In den ersten 4 Wochen nach einer Aneurysmaruptur kommt es ohne Ausschaltung der Blutungsquelle in ca. 40 % der Fälle zu einer Reruptur. Diese hat eine noch schlechtere Prognose als die erste Blutung. Hieraus resultiert die Empfehlung einer möglichst raschen Aneurysmaausschaltung innerhalb der ersten 72 Stunden nach der Blutung, d. h. noch vor Einsetzen der Vasospasmusphase.
Als Verfahren für die Aneurysmaausschaltung stehen das mikrochirurgische Clipping (◘ Abb. 17.10 a-d) und das endovaskuläre Coiling (◘ Abb. 17.10 e, f) zur Verfügung. Die Behandlungsoptionen sollten durch mikrochirurgisch erfahrene Neurochirurgen und Interventionalisten fallbezogen erörtert werden (Bederson et al. 2009; Raabe et al. 2005).
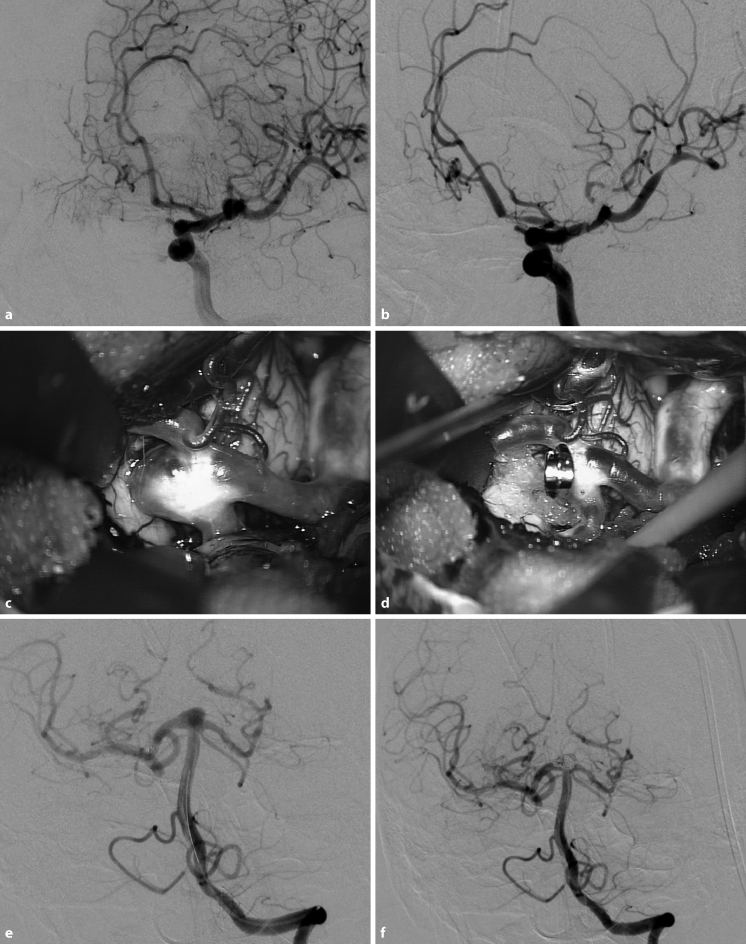

Abb. 17.10
a-f. Aneurysmaausschaltung. a, b Postoperative DSA-Kontrolle (rechts): ausgeschaltetes Aneurysma der Mediabifurkation durch Clipping. Nachweis von vasospastischen Veränderungen im M-2-Abschnitt der A. cerebri media und im Stromgebiet der A. cerebri anterior. c Mikrochirurgisches Clipping: intraoperative Aufnahme eines inzidentellen Aneurysmas der Mediabifurkation mit sichtbaren arteriosklerotischen Veränderungen der Gefäßwand. d Ausschaltung des Aneurysmas mit einem Clip unter Erhalt des Trägergefäßes (A. cerebri media) und der abgehenden Äste aus der Bifurkation. e, f Coilembolisation. DSA: Aneurysma der Basilarisspitze. Verschluss des Basilarisspitzenaneurysmas durch Coilembolisation (endovaskulär)
17.1.3.7 Akuter Hydrocephalus malresorptivus nach nicht-traumatischer SAB
Ein akuter Hydrocephalus malresorptivus nach stattgehabter nicht-traumatischer SAB kann rasch zu einer klinischen Verschlechterung mit Bewusstseinstrübung und Einklemmung führen. Therapeutisch wird eine externe Ventrikeldrainage über ein präkoronares Bohrloch angelegt (◘ Abb. 17.11). Alternativ kann eine lumbale Liquordrainage bei offenen Liquorwegen gelegt werden. In 15–20 % kommt es zu einem chronischen Hydrocephalus malresorptivus, welcher i. d. R. mit einem ventrikuloperitonealen Shunt versorgt wird (Bederson et al. 2009; van Gijn et al. 2007, 2001).
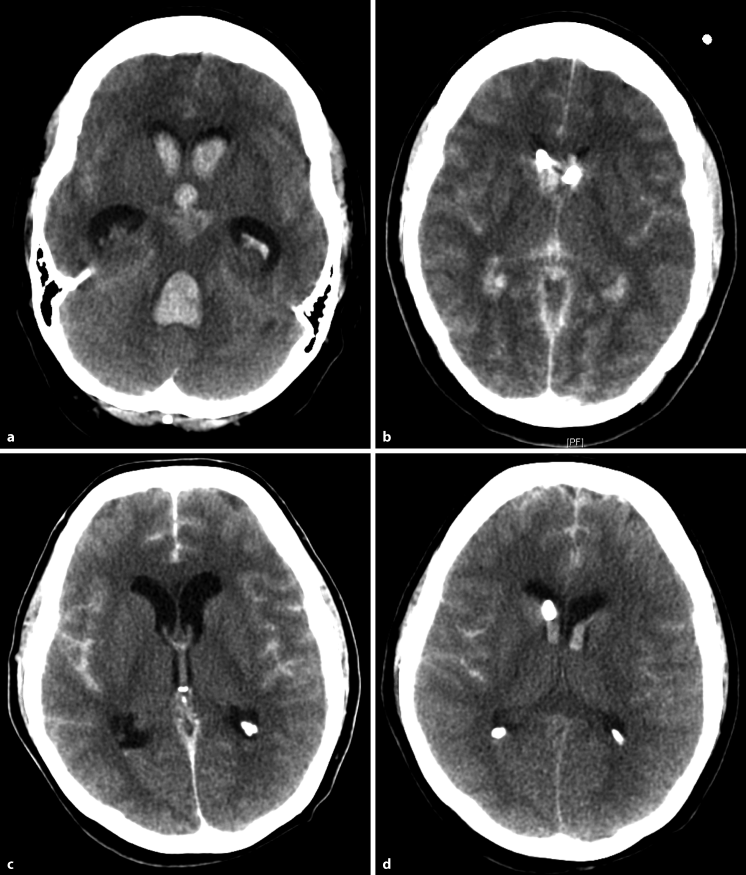

Abb. 17.11
a–d. Akuter Hydrocephalus malresorptivus. a, b CCT: SAB bei rupturiertem Basilarisspitzenaneurysma mit konsekutiver Liquorzirkulationsstörung. Versorgung des akuten Hydrocephalus malresorptivus mit externen Ventrikeldrainagen. c, d CCT: akuter Hydrocephalus malresorptivus bei Ruptur eines Aneurysmas der A. communicans anterior. Abnahme der Ventrikelweite nach Anlage einer externen Ventrikeldrainage rechts
17.1.3.8 Vasospasmen
Bei etwa 30–70 % der Patienten mit nicht-traumatischer SAB kommt es zwischen dem 4.–17. Tag nach dem Blutungsereignis zu einer angiographisch oder dopplersonographisch nachweisbaren Einengung der Hirngefäße (Vasospasmus; ◘ Abb. 17.10 a, b). Die Vasospasmen können lokal oder diffus auftreten (es kann z. B. auch die Gegenseite betroffen sein). Etwa die Hälfte dieser Patienten entwickeln klinische Symptome und neurologische Ausfallerscheinungen (symptomatische Vasospasmen). Die Symptome können im Schweregrad variieren und zeitlich betrachtet passager oder permanent (Hirninfarkte) sein. Bei etwa 7 % aller Patienten kommt es aufgrund der Vasospasmen zu multiplen Hirninfarkten mit konsekutiver Hirnschwellung und letaler Einklemmung.
Der zerebrale Vasospasmus ist die zweithäufigste Ursache für einen schlechten Krankheitsverlauf nach stattgehabter SAB, neben dem Blutungsereignis selbst (Bederson et al. 2009; van Gijn et al. 2007, 2001).
In der Behandlung des Vasospasmus ist die induzierte hypervolämische, hypertone Hämodilution (Triple-H-Therapie) weitgehend akzeptiert. Die Wirksamkeit dieser Therapie wird jedoch noch teilweise kontrovers diskutiert. Die prophylaktische Behandlung mit Nimodipin ist in vielen größeren neurochirurgischen Kliniken wegen der fraglichen Wirksamkeit mittlerweile wieder verlassen worden. Auch andere medikamentöse Ansätze in der Bekämpfung des Vasospasmus mit Statinen, Steroiden, Magnesium, Selen und Clazosentan blieben erfolglos (Bederson et al. 2009; van Gijn et al. 2007, 2001).
Als endovaskuläre Behandlungsmöglichkeiten des Vasospasmus werden in Einzelfällen die transluminale Ballondilatation (mechanische Aufweitung lokalisierter proximaler Gefäßeinengungen) und die intraarterielle Gabe vasodilatatorischer Substanzen (Papavarin, Nimodipin) angewendet. Nutzen und Risiken dieser Methoden sind Gegenstand laufender wissenschaftlicher Untersuchungen (Bederson et al. 2009; van Gijn et al. 2007, 2001).
17.1.4 Querschnittslähmung
17.1.4.1 Epidemiologie
Eine akute Querschnittslähmung ist immer ein Notfall. Das Ausmaß einer Querschnittslähmung kann komplett oder inkomplett sein. In 70 % der Fälle ist ein Trauma bzw. Unfall Ursache einer Querschnittslähmung, in 30 % liegen nicht-traumatische Gründe vor (Kattail et al. 2009).
In industrialisierten Staaten beträgt die Inzidenz für eine akute traumatische Rückenmarksläsion 1–4/100.000 Einwohner (Cripps et al. 2011). Männer sind mit einem Anteil von 70–80 % häufiger betroffen. Das durchschnittliche Lebensalter zum Zeitpunkt des Unfalls liegt bei 40 Jahren (National Spinal Cord Injury Statistical Center 2010). Unfallbedingte Paraplegien sind etwas häufiger als Tetraplegien (Felleiter et al. 2004). In etwa 40 % liegt eine Para- bzw. Tetraplegie vor (National Spinal Cord Injury Statistical Center 2010). Bei den Patienten mit Tetraplegie bleibt diese in 70 % der Fälle bestehen, in 23 % bessert sie sich zu einer hochgradigen Tetraparese und 20 % bleiben beatmungspflichtig (Marino et al. 2011). Bei thorakalen Querschnittsyndromen sind 82 % der Patienten paraplegisch (Zariffa et al. 2011).
Traumatische Ursachen sind (Kattail et al. 2009)
Stürze, meist aus großer Höhe (Gebäude, Treppen; 51 %),
Verkehrsunfälle (Auto, Zweiräder; 30 %),
Sport- und Freizeitunfälle (14 %),
Fremdverletzungen (5 %).
Bezüglich der verletzten Wirbelsäulenabschnitte besteht folgende Verteilung (Kattail et al. 2009):









